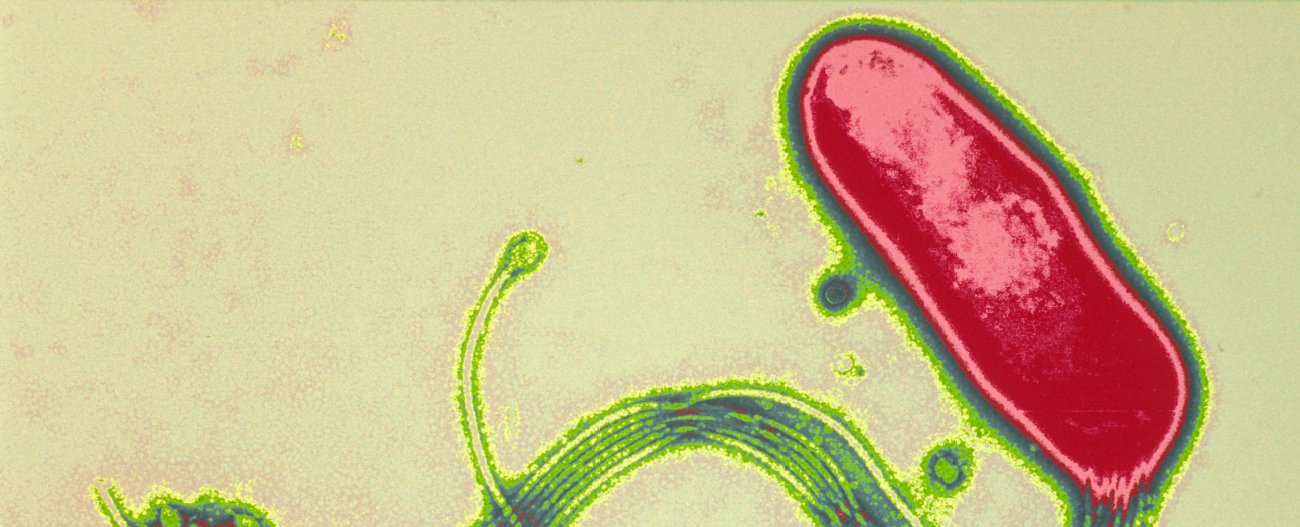
Gastrites, ulcères gastro-duodénaux et cancers de l’estomac
L’infection à H. pylori est acquise pendant l’enfance et perdure pendant des décennies, voire toute la vie de la personne infectée. Celle-ci développe une forte réponse inflammatoire locale et humorale qui s’installe progressivement dans la chronicité. Chez la plupart des individus, la gastrite chronique évolue sans autre conséquence et reste asymptomatique. Une proportion faible de patients (environ 10% des personnes infectées) développera au cours du temps une maladie ulcéreuse, et 1 % une néoplasie gastrique. Les données accumulées ces dernières années montrent toutefois que ces deux issues cliniques sont mutuellement exclusives, et que l’évolution vers l’une ou l’autre des pathologies est fonction de prédispositions génétiques de l’hôte, de facteurs environnementaux (alimentation en particulier), et de propriétés bactériennes. L’évolution de l’infection à H. pylori vers la maladie ulcéreuse est associée à une gastrite à prédominance antrale (partie basse de l’estomac) et à une hyper-sécrétion acide qui conduit à la colonisation et l’inflammation du duodénum, siège de l’ulcère duodénal (qui représente 95% des maladies ulcéreuses). L’évolution de l’infection vers l’atrophie gastrique puis le cancer gastrique est en général associée à une pangastrite (gastrite des parties hautes et basses de l’estomac). Elle s’observe généralement chez des patients présentant une hypo-sécrétion acide et touche plus particulièrement les populations de plus de 50 ans.
Ainsi, H. pylori a-t-elle le triste privilège d’avoir été reconnue comme la première bactérie impliquée dans la genèse d’un cancer, le cancer de l’estomac qui est la deuxième cause de mortalité par cancer dans le monde et la première dans les pays en voie de développement. Il y a 800 000 personnes qui meurent chaque année dans le monde de ce cancer, et 6000 nouveaux cas par an sont diagnostiqués en France.
Une infection très répandue
L’infection à H. pylori est l’une des infections chroniques les plus répandues dans le monde : de 20 à 90 % des individus adultes sont infectés selon les pays. Pour un pays donné, la prévalence varie en fonction du statut socio-économique des individus et du degré de promiscuité dans lequel ils vivent. L’infection est plus fréquente dans les pays en voie de développement (80 à 90%) que dans les pays industrialisés (25 à 30%). La bactérie se transmet directement d’homme à homme par voie orale et l’infection est acquise durant la petite enfance le plus souvent par une transmission intra-familiale (mère/enfant, fratrie). Tout se joue au stade de l’enfance : si un individu n’est pas infecté avant l’âge de 10 ans, le risque qu’il le soit plus tard est très faible. A l’heure actuelle, on ne dispose pas d’arguments convaincants permettant d’incriminer l’environnement (en particulier l’eau) comme source de contamination.
En France, la recherche et le traitement de H. pylori sont actuellement recommandés uniquement chez les malades ayant un ulcère prouvé ainsi que chez les malades ayant un lymphome du MALT, tumeur rare susceptible de régresser après traitement contre l’infection par H. pylori. Toutefois, les données épidémiologiques récentes concernant le rôle de H. pylori dans le processus de carcinogenèse gastrique posent le principe du diagnostic et du traitement en vue d’éliminer l’infection chez les personnes présentant un risque élevé : ce sont les malades ayant eu une gastrectomie partielle pour cancer; les parents du premier degré de malades ayant eu un cancer gastrique; les malades ayant des lésions prénéoplasiques (gastrite atrophique).
Diagnostic d’une infection
En France, compte-tenu des recommandations du corps médical, le diagnostic de l’infection à H. pylori se fait le plus souvent à partir des biopsies antrales et fondiques prélevées au cours de l’endoscopie par le gastroentérologue. Différents tests (dits invasifs car réalisés à partir des biopsies) sont possibles : 1) un examen histologique des biopsies permet de détecter la présence de H. pylori par examen microscopique ; 2) la mise en culture des bactéries à partir des biopsies peut également être réalisée ; elle a l’avantage de permettre, après antibiogramme, d’adapter le traitement antibiotique à la sensibilité de la bactérie isolée ; 3) on dispose maintenant de tests moléculaires d’amplification génique permettant la détection rapide de H. pylori et la détermination de sa sensibilité à la clarithromycine. (Les méthodes bactériologiques (2) et moléculaires (3) restent toutefois limitées à certains centres hospitaliers spécialisés). Un résultat positif ou négatif à partir d’un test invasif est généralement confirmé par la détection de l’infection par un test non-invasif, réalisable dans n’importe quel laboratoire d’analyses médicales, tel qu’une sérologie à H. pylori, ou la détection d’antigènes de H. pylori dans les selles des patients ou encore d’un test respiratoire à l’urée marquée au 13C. Ce test incontestablement le plus sensible, est utilisé systématiquement pour s’assurer du succès du traitement trois à quatre semaines après son arrêt.
Une trithérapie adaptée pour éliminer l’infection et guérir les ulcères
Pour éliminer l’infection par H. pylori, une trithérapie de 7 jours associant un inhibiteur puissant de l’acidité gastrique (inhibiteur de pompe à protons ou IPP) et deux antibiotiques (parmi l’amoxicilline, la clarithromycine et le métronidazole) est nécessaire. Dans ces conditions, la bactérie est éradiquée dans 70 % des cas. Les facteurs d’échec sont la résistance primaire à la clarithromycine retrouvée dans environ 20 % des cas, celle au métronidazole retrouvée dans 30 % des cas ou encore la mauvaise observance du traitement. Après un traitement de deuxième ligne, adapté à la sensibilité des bactéries aux antibiotiques, 90 % des patients sont guéris de leur infection. Le traitement fait disparaître en quelques jours la bactérie et les signes de l’infection. L’inflammation persiste pendant 6 à 24 mois, puis la muqueuse redevient normale.
A l’Institut Pasteur
Deux équipes de l’Institut Pasteur sont spécialisées dans l’étude de la bactérie Helicobacter pylori et de son rôle dans le développement de pathologies gastriques.
L’Unité de Pathogenèse de Helicobacter, dirigée par Hilde De Reuse, cherche à comprendre les mécanismes moléculaires qui permettent à cette bactérie de survivre dans l’environnement hostile de l’estomac et de s’y maintenir pendant des années en y provoquant des lésions. En décryptant les mécanismes intimes du fonctionnement de cette bactérie, ce groupe de recherche vise parallèlement à trouver de nouvelles cibles pour les médicaments. De plus, cette équipe étudie les facteurs et les mécanismes responsables d’instabilités génétiques des cellules de l’estomac lors de l’infection par H. pylori, des événements potentiellement impliqués dans les étapes précoces de cancérisation.
Le groupe Biologie et génétique de la paroi bactérienne, dirigé par Ivo Gomperts Boneca, cherche à étudier comment Helicobacter pylori construit son enveloppe la plus externe, la paroi bactérienne. Cette paroi, essentielle aux bactéries, constitue une excellente cible thérapeutique comme le démontre l’efficacité des antibiotiques comme la pénicilline. Ainsi, ce groupe veut approfondir les connaissances sur la construction de la paroi pour développer de nouveaux antibiotiques qui permettraient de répondre aux problèmes de résistance. De plus, cette paroi, étant unique aux bactéries, est utilisée par les organismes multicellulaires pour détecter ces bactéries et établir une réponse immunitaire adéquate. Ce groupe étudie également les stratégies de camouflage de la paroi mises en place par les bactéries, et en particulier par H. pylori, pour échapper à leur détection chez l’hôte et permettre leur persistance.
Janvier 2009